니코틴아마이드 아데닌 다이뉴클레오타이드 인산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADP+)은 NAD+와 유사한 구조를 가지며, 아데노신의 2' 위치에 인산염이 붙어있는 조효소이다. NADP+는 NADPH의 형태로 환원되어 다양한 생합성 반응에 필요한 환원력을 제공하며, 활성 산소로부터 세포를 보호하는 데 기여한다. NADPH는 오탄당 인산 경로, 광합성, 미토콘드리아 등 다양한 경로를 통해 생성되며, 캘빈 회로, 지방산 합성, 글루타티온 환원 등 여러 대사 과정에 관여한다.
더 읽어볼만한 페이지
- 피리디늄 화합물 - 파라콰트
파라콰트는 1882년 합성되어 1961년부터 상업 생산된 비선택성 접촉형 제초제이지만, 인체 독성이 높아 여러 국가에서 사용이 금지되거나 제한되고 있으며 파킨슨병과의 연관성도 제기되고 있다. - 피리디늄 화합물 - 니코틴아마이드 아데닌 다이뉴클레오타이드
니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+)는 산화환원반응에 관여하는 조효소로서, 데노보 경로와 회수 경로를 통해 생합성되며 세포의 산화 환원 상태 지표로 활용되고 다양한 생화학적 과정에 관여하여 약리학 및 질병 치료 연구에서 중요한 역할을 한다. - 산화 환원 효소 - 플라빈 모노뉴클레오타이드
플라빈 모노뉴클레오타이드는 식품의 색상을 개선하는 데 사용되는 오렌지-레드색의 식품 첨가 색소로, 아이소알록사진 고리와 인산기를 포함하는 구조를 가지며, 섭취 후 리보플라빈으로 전환되는 나트륨 염은 아기 및 어린이를 위한 식품 등에 사용된다. - 산화 환원 효소 - 산화 효소
산화 효소는 생체 내 산화·환원 반응을 촉매하는 효소로, 다양한 종류가 있으며 미생물학에서는 세균 균주 동정 및 호기성/혐기성 여부 판단에 사용된다. - 보조 인자 - 피롤로퀴놀린 퀴논
피롤로퀴놀린 퀴논(PQQ)은 세균에서 발견되는 산화환원 반응 보조 인자로서, 여러 효소 활성에 관여하고 단백질과 결합하여 퀴노프로테인을 형성하며, 항산화 및 신경 보호 작용을 하는 것으로 알려졌지만 포유류 필수 영양소 여부는 불확실하고 코코아, 모유, 낫토 등에 존재한다. - 보조 인자 - 필로퀴논
필로퀴논은 비타민 K₁이라고도 불리는 지용성 비타민으로, 동물에서는 혈액 응고와 뼈 형성에, 식물과 시아노박테리아에서는 광합성에 중요한 역할을 하며, 의학적으로는 출혈 장애 치료와 비타민 K 결핍증 예방에 사용된다.
2. NADP+의 구조 및 특성
NADP+는 기본적으로 NAD+와 구조가 거의 같으며, 니코틴아마이드와 아데노신으로 구성된다. 다만, 아데노신의 리보스 2' 위치에 수소 대신 인산기가 결합되어 있다.
NADP+의 기본 골격은 NAD+와 거의 같기 때문에 NAD+의 아데닌 잔기와 연결된 리보스의 2' 위치에 인산기만 붙으면 NADP+가 합성된다.
NADPH는 NADP+로부터 생성된다. NADPH의 주요 생성 경로는 다음과 같다.
NADP+의 환원 방식은 NAD+와 동일하며, 두 물질 모두 뉴클레오타이드를 포함하므로 260nm 파장의 자외선을 흡수한다. NADPH는 340nm 파장의 빛도 흡수한다. NADP+ 의존성 탈수소효소는 NAD+에는 활성을 나타내지 않으므로(서로 다른 효소번호[27]를 가짐), 340nm에서 NADP+ 의존성 탈수소효소의 활성도를 측정할 때 NAD+의 방해 효과가 없다.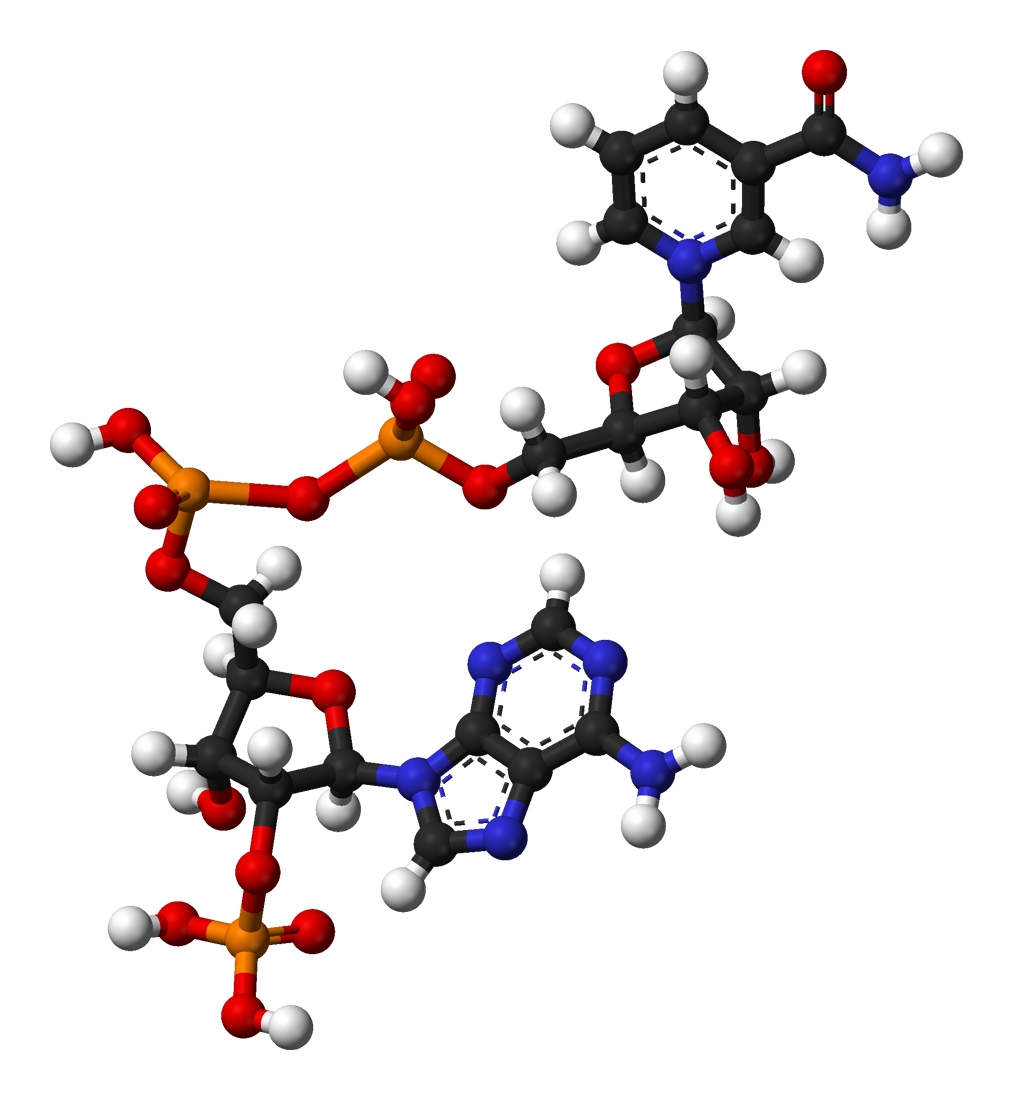
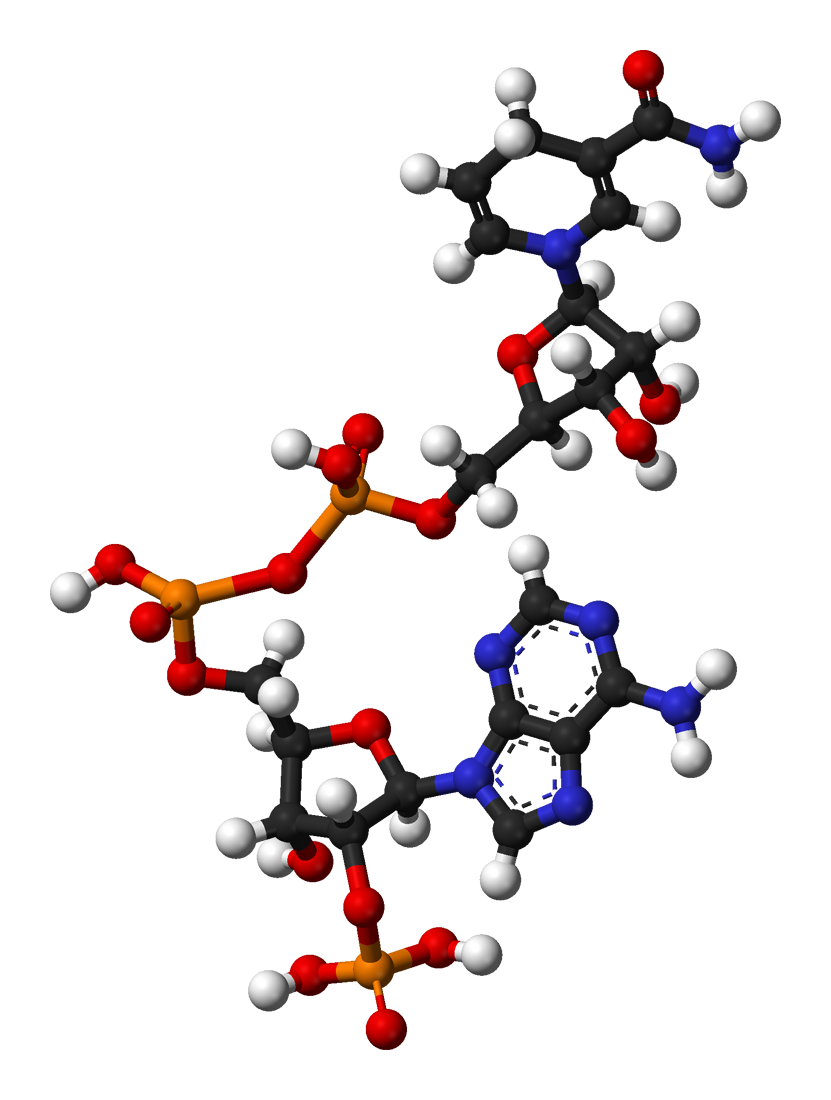
3. NADP+의 합성
:NAD+ + ATP → NADP+ + ADP
일반적으로, NADPH가 합성되기 전에 NADP+가 합성된다. 이러한 반응은 보통 NAD+로부터 시작되며, 이는 *de novo* 또는 재활용 경로에서 유래하며, NAD+ 키나아제가 추가적인 인산기를 더한다.[3] ADP-리보실 시클라아제는 재활용 경로에서 니코틴아마이드로부터의 합성을 가능하게 하며, NADP+ 포스파타아제는 NADPH를 NADH로 다시 변환하여 균형을 유지할 수 있게 한다.[3] 일부 형태의 NAD+ 키나아제, 특히 미토콘드리아 내의 것은 NADH를 직접 NADPH로 전환하는 데에도 관여할 수 있다.[5][6] 원핵생물 경로는 덜 알려져 있지만, 모든 유사한 단백질을 고려할 때 과정은 유사한 방식으로 작동할 것으로 보인다.[3]
4. NADPH의 합성
4. 1. 오탄당 인산 경로
오탄당 인산 경로는 동물과 다른 비광합성 생물에서 NADPH의 주요 공급원이다.[21] 이 경로에서 NADPH는 NADP+로부터 생성된다. 포도당-6-인산 탈수소효소(G6PDH)는 오탄당 인산 경로의 첫 번째 단계에서 NADP+를 NADPH로 환원시킨다. 오탄당 인산 경로는 포도당으로부터 오탄당과 NADPH를 생성한다. 일부 박테리아는 Entner–Doudoroff 경로에서 G6PDH를 사용하기도 하지만, NADPH 생성량은 동일하다.[3]
4. 2. 엔트너-듀도로프 경로
일부 세균은 엔트너-듀도로프 경로에서 포도당-6-인산 탈수소효소(G6PDH)를 통해 NADPH를 생성한다.[3]
: 포도당 6-인산 + NADP+ → 6-포스포글루코노-δ-락톤 + NADPH
4. 3. 광합성
페레독신-NADP(+) 환원효소는 광합성의 명반응 전자 전달 사슬의 마지막 단계에 나타난다. 이 효소는 캘빈 회로에서 이산화탄소를 동화하여 포도당으로 전환하는 데 필요한 환원력을 제공한다.[3] 광계 I 복합체에서 환원된 페레독신(Fd)이 NADP+로 전자를 전달하여 NADPH를 생성하는데, 이는 비순환적 광인산화에서 일어난다. 이 반응에는 페레독신-NADP+ 산화환원효소(FNR)가 관여한다. 순환적 광인산화에서는 페레독신이 플라스토퀴논(PQ)으로 전자를 전달하여 NADPH를 생성하지 않는다.[3] 또한 NADPH는 질소 순환에서 식물이 질산을 암모니아로 환원시키거나, 오일 생산 과정에도 필요하다.[3]
4. 4. 미토콘드리아
동물과 다른 비광합성 생물에서 NADPH의 주요 공급원은 오탄당 인산 경로이다. NADPH를 생성하는 덜 알려진 몇 가지 다른 대사경로가 있으며, 이 대사경로들은 모두 미토콘드리아의 존재에 의존한다. 이러한 과정에서 핵심 효소들은 NADP-결합 사과산 효소, NADP-결합 아이소시트르산 탈수소효소, NADP-결합 글루탐산 탈수소효소, 니코틴아마이드 뉴클레오타이드 트랜스하이드로제네이스이다.[21] 아이소시트르산 탈수소효소의 메커니즘은 지방세포와 간세포에서 NADPH의 주요 공급원인 것으로 보인다.[22]
NADPH 생성과 관련된 또 다른 탄소 대사 관련 경로는 미토콘드리아 엽산 주기이며, 이 경로는 주로 세린을 1탄소 단위의 공급원으로 사용하여 미토콘드리아에서 뉴클레오타이드 합성 및 산화 환원 항상성을 유지한다. 미토콘드리아 엽산 주기는 최근 암세포의 미토콘드리아에서 NADPH 생성의 주요 기여자로 제시되었다.[9]
4. 5. 기타 경로
오탄당 인산 경로는 동물과 다른 비광합성 생물에서 NADPH의 주요 공급원이지만, 덜 알려진 다른 여러 대사경로들도 NADPH를 생성하며, 이들은 모두 미토콘드리아의 존재에 의존한다.[21]
NADPH는 탄소 대사와 관련 없는 경로를 통해서도 생성될 수 있는데, 페레독신 환원효소가 그러한 예이다. 니코틴아마이드 뉴클레오타이드 트랜스수소화효소는 NAD(P)H와 NAD(P)+ 사이에서 수소를 전달하며, 진핵생물 미토콘드리아 및 많은 박테리아에서 발견된다. 이 효소는 작동에 양성자 기울기가 필요한 버전과 그렇지 않은 버전이 있다. 일부 혐기성 유기체는 수소 탈수소효소 (NADP+)를 사용하여 수소 기체에서 수소화물을 떼어내어 양성자와 NADPH를 생성한다.[3]
5. NADPH의 산화
NADPH는 산화환원 반응 및 생합성 반응에 필요한 전자를 제공한다.[23] NADPH는 글루타티온을 재생하여 활성산소로부터 세포를 보호하고, 콜레스테롤 합성, 지방산 사슬 연장과 같은 동화작용에 사용된다.[23] 또한 NADPH는 면역세포에서 자유 라디칼을 생성하여 병원체를 파괴하는 호흡폭발 과정에 관여하며,[24] 방향족 화합물, 스테로이드, 알코올, 약물의 사이토크롬 P450 하이드록실화에 필요한 전자를 제공한다.[24]
5. 1. 캘빈 회로
글리세르알데하이드 3-인산 탈수소효소는 1,3-비스포스포글리세르산에 NADPH를 사용하여 글리세르알데하이드 3-인산으로 환원시키는 반응을 촉매한다. 이 과정에서 NADP+와 인산(Pi)이 생성된다.: 1,3-비스포스포글리세르산 + NADPH → 글리세르알데하이드 3-인산 + NADP+ + Pi
지방산 합성 과정에서도 NADP+가 관여한다.
: 아세토아세틸-ACP + NADPH → β-하이드록시뷰티릴-ACP + NADP+
: 크로토닐-ACP + NADPH → 뷰틸-ACP + NADP+
- ACP: 아실 운반 단백질
C4 식물이나 CAM 식물의 광합성에서도 NADPH가 사용된다.
NADP+/NADPH는 주로 동화작용에서 사용되고, NAD+/NADH는 주로 이화작용에서 사용된다.
5. 2. 지방산 합성
NADP+/NADPH는 지방산 합성 과정에서 사용된다.- 아세토아세틸-ACP (아실 운반 단백질) + NADPH → β-하이드록시뷰티릴-ACP + NADP+
- 크로토닐-ACP + NADPH → 뷰틸-ACP + NADP+
5. 3. C4 및 CAM 식물
C4 식물이나 CAM 식물의 광합성에서도 NADPH가 사용된다.[1]5. 4. 글루타티온 환원
산화형 글루타티온(GSSG)은 글루타티온 환원효소에 의해 NADPH를 사용하여 환원형 글루타티온(GSH)으로 환원된다.[1]- 산화형 글루타티온(GSSG) + NADPH → 환원형 글루타티온(GSH) + NADP+
6. NADPH의 기능
NADPH는 글루타티온을 재생해서 활성산소의 독성으로부터 보호하는 것을 포함하는 산화환원 반응 및 생합성 반응에 대한 환원당량을 제공한다.[23] NADPH는 콜레스테롤의 합성과 지방산 사슬의 연장과 같은 동화작용에 사용된다.
또한 NADPH 시스템은 면역세포에서 자유 라디칼의 생성을 담당한다. 이러한 라디칼은 호흡폭발이라 불리는 과정에서 병원체를 파괴하는데 사용된다.[24] 이는 방향족 화합물, 스테로이드, 알코올, 약물의 사이토크롬 P450의 하이드록실화에 대한 환원당량의 원천이다.
NADPH는 생합성 반응에 필요한 환원제(일반적으로 수소 원자)를 제공하며, 활성 산소 (ROS)의 독성에 대한 방어와 관련된 산화-환원 반응을 수행하여 글루타티온 (GSH)의 재생을 가능하게 한다.[11] NADPH는 또한 콜레스테롤 생합성, 스테로이드 생합성,[12] 아스코르브산 생합성,[12] 자일리톨 생합성,[12] 세포질 지방산 생합성[12] 및 미소체 지방산 사슬 연장과 같은 동화 작용 경로에도 사용된다.
NADPH 시스템은 또한 NADPH 산화효소에 의해 면역 세포에서 자유 라디칼을 생성하는 데에도 관여한다. 이러한 라디칼은 호흡 폭발이라는 과정을 통해 병원체를 파괴하는 데 사용된다.[13] 이는 방향족 화합물, 스테로이드, 알코올 및 약물의 시토크롬 P450 수산화 반응에 필요한 환원 등가물의 공급원이다.
NADPH는 생체 내 전자 전달에 기여하며, 그중에서도 유명한 것이 광합성의 전자 전달 물질로서의 역할이다. 또한, 해당 과정은 해당 당분해 과정의 엔트너-도우드로프 경로, 지방산 및 스테로이드 생합성에도 기능한다.
7. NADP(H)를 조효소로 사용하는 효소
아드레노독신 환원효소는 대부분의 생물체에 보편적으로 존재하는 효소이다.[25] 이 효소는 두 개의 전자를 NADPH에서 FAD로 전달한다. 척추동물에서 이 효소는 스테로이드 호르몬을 합성하는 미토콘드리아의 P450 시스템의 사슬에서 첫 번째 효소로 작용한다.[26]
NADP를 결합하는 많은 효소는 "Rossmann fold"라고 불리는 공통적인 초이차 구조를 공유한다. 초기 베타-알파-베타(βαβ) 폴드는 Rossmann fold의 가장 잘 보존된 부분이다. 이 부분은 NADP의 ADP 부분과 접촉한다. 따라서 "ADP-결합 βαβ fold"라고도 불린다.[16]
8. NADP(H)를 기질로 사용하는 효소
세포질 단백질 MESH1[19]과 미토콘드리아 단백질 녹터닌[20]은 진핵생물에서 NADP(H)의 2' 인산을 제거하는 효소이다. MESH1 ([https://www.rcsb.org/structure/5vxA 5VXA])과 녹터닌 ([https://www.rcsb.org/structure/6nf0 6NF0])의 구조와 NADPH 결합은 관련이 없다.
9. 안정성
NADH와 NADPH는 염기성 용액에서 매우 안정적이지만, NAD+와 NADP+는 염기성 용액에서 분해되어 정량에 편리하게 사용할 수 있는 형광 물질을 생성한다. 반대로, NADPH와 NADH는 산성 용액에서 분해되는 반면, NAD+/NADP+는 산에 비교적 안정적이다.[14][15]
참조
[1]
웹사이트
NADP nicotinamide-adenine-dinucleotide phosphate
https://pubchem.ncbi[...]
U.S. National Library of Medicine
2024-08-22
[2]
서적
Introduction to Modern Biochemistry
https://books.google[...]
Academic Press
2014-05-12
[3]
논문
NADPH-generating systems in bacteria and archaea
2015
[4]
논문
Structure and function of NAD kinase and NADP phosphatase: key enzymes that regulate the intracellular balance of NAD(H) and NADP(H)
2008-04
[5]
논문
Characterization of NADH kinase from Saccharomyces cerevisiae
1989-04
[6]
논문
Localization of the NADH kinase in the inner membrane of yeast mitochondria
1989-06
[7]
논문
Routes and regulation of NADPH production in steroidogenic mitochondria
1995-02
[8]
웹사이트
10.4.3 Supply of NADPH for fatty acid synthesis
http://watcut.uwater[...]
2012-04-06
[9]
논문
Escaping Death: Mitochondrial Redox Homeostasis in Cancer Cells
2017-06
[10]
논문
Separating NADH and NADPH fluorescence in live cells and tissues using FLIM
Springer Science and Business Media LLC
2014-05
[11]
논문
Organic hydroperoxide-induced lipid peroxidation and cell death in isolated hepatocytes
1985-05
[12]
서적
Harper's illustrated Biochemistry, 30th edition
McGraw Hill
[13]
논문
The association of elevated reactive oxygen species levels from neutrophils with low-grade inflammation in the elderly
2008-10
[14]
서적
Enzymatic analysis : a practical guide
Humana Press
[15]
논문
Extraction and Quantitation of Nicotinamide Adenine Dinucleotide Redox Cofactors
2018-01
[16]
논문
Proteopedia: Rossmann fold: A beta-alpha-beta fold at dinucleotide binding sites
2015
[17]
논문
Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme
2017-12
[18]
논문
Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis
1992-12
[19]
논문
Mammalian stringent-like response mediated by the cytosolic NADPH phosphatase MESH1
[20]
논문
The metabolites NADP+ and NADPH are the targets of the circadian protein Nocturnin (Curled)
2019-05
[21]
논문
Routes and regulation of NADPH production in steroidogenic mitochondria
1995-02
[22]
웹인용
10.4.3 Supply of NADPH for fatty acid synthesis
http://watcut.uwater[...]
2012-04-06
[23]
논문
Organic hydroperoxide-induced lipid peroxidation and cell death in isolated hepatocytes
1985-05
[24]
논문
The association of elevated reactive oxygen species levels from neutrophils with low-grade inflammation in the elderly
2008-10
[25]
논문
Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme
[26]
논문
Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis
https://archive.org/[...]
1992-12
[27]
문서
EC #: Enzyme Commision number
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

